Vliv kmenových buněk v podpoře hojení ran

Mezenchymální kmenové buňky mají mnoho funkcí a jsou používány v mnoha výzkumných studiích. V poslední době se do popředí výzkumu dostává i vliv kmenových buněk na hojení ran.
Mezenchymální kmenové buňky jsou zodpovědné zejména za obnovu tkání kostí, šlach, svalstva, ale také tuku. Je ovšem známo, že mají mnohem širší potenciál v podpoře hojení ran, neboť vylučují množství protizánětlivých faktorů a mají schopnost přeměny v jiný buněčný typ. Všechny tyto vlastnosti jsou výhodné při podpoře hojení poškozené tkáně. V místě poraněné tkáně podporují mezenchymální kmenové buňky tvorbu nových cév, omezují záněty a udržují okolní buňky naživu.
Hojení ran je dobře zorganizovaný proces, kdy se postupně aktivuje nebo inhibuje řada faktorů. Jde o proces obnovování poraněné tkáně, což je jeden z nejdůležitějších terapeutických cílů. Tento proces se skládá ze tří fází. Prvním krokem je zánětlivá změna s aktivací vrozené imunity, po které následuje fáze proliferace, včetně fibroplazie, angiogeneze, a nakonec reepitelizace.

Hojení ran je komplexní proces a probíhá různě podle typu rány. Proces se liší dle rozsahu, velikosti a lokalizace rány a také dle prvotního ošetření a kontaminace. Hojení je velmi závislé na faktorech, jako je věk a zdravotní stav. V tomto procesu se tvoří granulační tkáň, která postupně přechází v tkáň zjizvenou. Délka trvání hojení je také různá dle typu rány. Může trvat pár týdnů, ale také několik měsíců. Obecně se hojí hůře rány na končetinách a ty, které zasahují do hlubších vrstev.
K regeneraci poškozené tkáně mohou být použity tkáňové kmenové buňky a embryonální kmenové buňky. Z hlediska etických problémů je však využití embryonálních kmenových buněk v klinické aplikaci limitováno. U ran způsobených popáleninou se předpokládá využití tkáňových kmenových buněk, zejména buněk mezenchymálních. Tyto buňky lze získat například z tukové tkáně, pupečníkové krve či pupečníkové tkáně a kostní dřeně. Regenerace popálenin může být dosažena jak po autologní, tak po allogenní transplantaci mezenchymálních kmenových buněk.
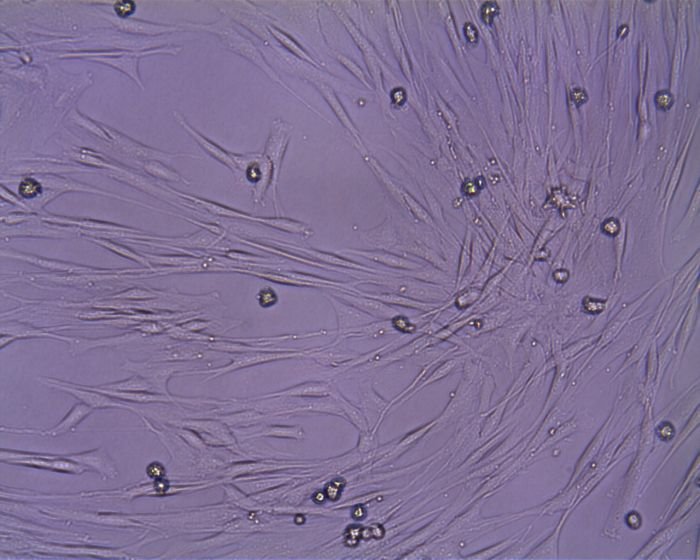
Psí mezenchymální kmenové buňky z kostní dřeně.

Psí mezenchymální kmenové buňky z tukové tkáně.
Z proběhlých studií je již známo, že mezenchymální kmenové buňky z kostní dřeně se mohou in vitro diferencovat ve fibroblasty a epidermální buňky. V kombinaci s vhodným nosičem poté signifikantně urychlují hojení kožní rány in vivo. Kmenové buňky získané z tukové tkáně mají vliv na podporu proliferace dermálních fibroblastů a reepitelizaci kožních ran. Pupečníkové kmenové buňky jsou zase schopny diferenciace v keratinocyty in vitro.
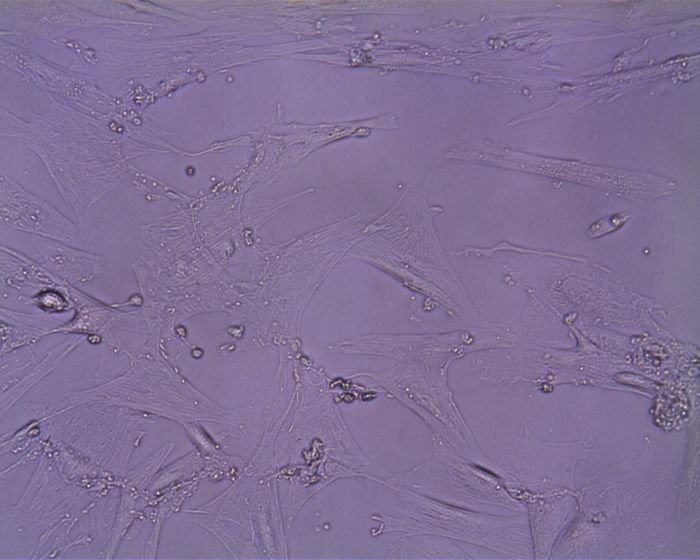
Psí mezenchymální kmenové buňky z pupečníku.
V průběhu hojení je také nezanedbatelný parakrinní efekt tkáňových kmenových buněk. Mezenchymální kmenové buňky získané z kostní dřeně jsou schopny transkripce kolagenu typu I a III, zatímco buňky rány pouze kolagenu typu I. U kmenových buněk z tukové tkáně je parakrinní efekt popsán také. Tyto buňky podporují proliferaci dermálních fibroblastů přímým kontaktem buněk a indukovanou parakrinní aktivací, což má za následek významné urychlení reepitelizace při hojení ran. Ve studiích o parakrinním efektu mezenchymálních kmenových buněk je zmíněno, že tkáňové kmenové buňky jsou v průběhu opravy tkáně schopny měnit mikroprostředí tkáně cestou sekrece solubilních faktorů významněji než svou multipotentní diferenciací.
V procesu hojení je taktéž důležitá regulace imunitní a zánětlivé odpovědi. Tuto vlastnost mají tkáňové kmenové buňky také. Z proběhlých pokusů na potkanech je známo, že aplikace autologních a alogenních mezenchymálních kmenových buněk na povrch hlubokých popálenin zmenšuje zánětlivou buněčnou infiltraci v ráně a urychluje novotvorbu granulační tkáně.
Po poranění kůže jsou multipotentní kmenové buňky mobilizovány z kostní dřeně do krevního oběhu, odkud poté migrují do místa poranění. V místě poranění poté regulují proliferaci a migraci epiteliálních a dermálních mezenchymálních kmenových buněk v průběhu časné fáze zánětu.
Klinický případ
V následujícím popsaném klinickém případu se skupina italských vědců rozhodla využít výše popsaných poznatků o kmenových buňkách v léčbě kožní rány u hříběte.
Pacientem v této studii byla šestiměsíční klisna, která se narodila s angulárními deformitami. Tyto patologické změny jí znemožňovaly stát bez pomoci. V důsledku toho se u klisny vytvořil na levém patním hrbolu dekubitus. Rána byla klasifikována dle Sessing classification (SC) jako stupeň 4 a dle National Pressure Ulcer Advisory Panel (NPUA) jako stupeň 3. Okolí rány bylo denně čištěno a bandážováno. Po deseti dnech se stav rány mírně zlepšil a rána byla klasifikována dle SC jako stupeň 3 a dle NPUA jako stupeň 2. Hříbě bylo poté převezeno z kliniky na farmu, kde léčba dále pokračovala. Do dvou měsíců byla rána kompletně zacelena. O měsíc později (tedy po třech měsících) se stav rány o dost zhoršil z důvodu soustavného ležení zvířete v poloze zatěžující postižené místo, a došlo k znovuotevření rány. Nakonec stav dosáhl stupně 5 dle SC a 4 dle NPUA a došlo k nekróze kůže a podkoží. Rána musela být ošetřena chirurgicky a bylo rozhodnuto o léčbě s použitím mezenchymálních kmenových buněk.
K léčbě byly použity mezenchymální kmenové buňky izolované z tkáně pupečníku (tzv. Whartonova rosolu) zdravé dárkyně. Klisna byla negativně testována na infekční anémii koní a očkována na tetanus, herpesvirus a influenzu koní. Jako nosič pro aplikaci kmenových buněk byl použit karboxymetylcelulózový gel. Těsně před aplikací byla rána omyta fyziologickým roztokem a okolí rány bylo ošetřeno vazelínou. Buňky byly sterilně naneseny v množství 5 × 106 na gel a přiloženy na ránu. Rána byla poté obvázána sterilními obvazy. Gel s buňkami se vyměňoval každý čtvrtý den (den 8, 12, 16, 20). Čtyři dny po poslední aplikaci byly obvazy odstraněny a rána byla ošetřována pouze výplachy. Po cca 30 dnech bylo hříbě opět propuštěno na farmu, kde pokračovaly oplachy rány. Po několika dnech se rána zhojila bez relapsů. Během léčby se nevyskytly žádné vedlejší účinky.

Postup hojení rány. Číslo označuje den od aplikace.
Závěr
K hojení ran přispívají kmenové buňky svými schopnostmi multipotence, parakrinního efektu a modulace imunitní odpovědi. Proto je léčba kmenovými buňkami velmi slibným prostředkem k hojení ran, v budoucnu obzvláště těch způsobených popáleninami.
Ing. Petra Černá působí jako odborný asistent projektu Avecell. AVECELL® je veterinární projekt Medicínského centra Praha, v němž se tým odborníků zaměřuje na výzkum a využití nových metod léčby pomocí aplikace kmenových buněk ve veterinární medicíně.
Medicínské centrum Praha získalo povolení pro výrobu veterinárního léčivého přípravku (autologní mezenchymální kmenové buňky) od Ústavu pro státní kontrolu veterinárních biopreparátů a léčiv (ÚSKVBL) v květnu 2015.

Zdroje:
- Fathke, C., Wilson, L., Hutter, J., Kapoor, V., Smith, A., Hocking, A., Isik, F. (2004). Contribution of bone marrow–derived cells to skin: collagen deposition and wound repair. Stem cells, 22(5), 812-822.
- He, L., Nan, X., Wang, Y., Guan, L., Bai, C., Shi, S., Yuan, H., Chen, L., Pei, X. (2007). Full-thickness tissue engineered skin constructed with autogenic bone marrow mesenchymal stem cells. Science in China Series C: Life Sciences, 50(4), 429-437.
- Kamolz, L. P., Kolbus, A., Wick, N., Mazal, P. R., Eisenbock, B., Burjak, S., Meissl, G. (2006). Cultured human epithelium: human umbilical cord blood stem cells differentiate into keratinocytes under in vitro conditions. Burns, 32(1), 16-19.
- Kim, W. S., Park, B. S., Sung, J. H., Yang, J. M., Park, S. B., Kwak, S. J., Park, J. S. (2007). Wound healing effect of adipose-derived stem cells: a critical role of secretory factors on human dermal fibroblasts. Journal of dermatological science, 48(1), 15-24.
- Lanci, A., Merlo, B., Mariella, J., Castagnetti, C., Iacono, E. (2019). Heterologous Wharton's jelly derived mesenchymal stem cells application on a large chronic skin wound in a 6-month-old filly. Frontiers in Veterinary Science, 6, 9.
- Maxson, S., Lopez, E. A., Yoo, D., Danilkovitch-Miagkova, A., LeRoux, M. A. (2012). Concise review: role of mesenchymal stem cells in wound repair. Stem cells translational medicine, 1(2), 142-149.
- Phinney, D. G., Prockop, D. J. (2007). Concise review: mesenchymal stem/multipotent stromal cells: the state of transdifferentiation and modes of tissue repair—current views. Stem cells, 25(11), 2896-2902.
- Prockop, D. J. (2007). “Stemness” does not explain the repair of many tissues by mesenchymal stem/multipotent stromal cells (MSCs). Clinical Pharmacology & Therapeutics, 82(3), 241-243.
- Shumakov, V. I., Onishchenko, N. A., Rasulov, M. F., Krasheninnikov, M. E., Zaidenov, V. A. (2003). Mesenchymal bone marrow stem cells more effectively stimulate regeneration of deep burn wounds than embryonic fibroblasts. Bulletin of experimental biology and medicine, 136(2), 192-195.
- Wu, Y., Chen, L., Scott, P. G., & Tredget, E. E. (2007). Mesenchymal stem cells enhance wound healing through differentiation and angiogenesis. Stem cells, 25(10), 2648-2659.
Galerie






V posledních letech dochází k významnému vývoji v oblasti využití mezenchymálních kmenových buněk (MSC) ve veterinární léčbě, a to včetně…

Počasí je stále poměrně nevyzpytelné. Koně jsou velmi adaptabilní a obvykle výrazné změny počasí zvládnou. Když ale ovlivňujeme jejich přirozené…









