Při laminitidě dochází k zánětu kopytní škáry, což vede k destrukci spojení mezi kopytní kostí a rohovým pouzdrem kopyta. Za normálních okolností je toto spojení pevné, podobné jako v případě lidského nehtu. Toto spojení je tvořeno lamelami (epidermální a dermální), mezi nimiž je bazální membrána.
Lamely jsou ve spojení s rohovým pouzdrem kopyta (epidermální) nebo kopytní kostí (dermální) a tvoří závěsný aparát kopytní kosti. Lamely jsou živé buňky a potřebují tedy krevní zásobení a inervaci. V důsledku laminitidy dochází k narušení a destrukci lamel a závěsného aparátu, nastává pokles a rotace kopytní kosti distálním směrem, což vyvolává poškození chodidlové škáry vedoucí k výrazné bolestivosti.
Laminitida bohužel může negativně ovlivňovat kvalitu života zvířete natolik, že může vést k rozhodnutí o jeho eutanázii. Nejčastěji jsou postiženy obě přední končetiny (nejspíše kvůli tomu, že nesou 60 % váhy koně), ale může být postiženo jenom jedno kopyto nebo naopak všechna.

Příčin vzniku laminitidy je více a důležité je uvědomit si, že ve většině případů to není pouze onemocnění kopyta, ale důsledek systémového onemocnění. Nejčastějšími příčinami jsou nevhodné složení krmné dávky (nadbytek lehce stravitelných sacharidů, tzv. NSC), stavy vedoucí k inzulinové rezistenci (Cushingův syndrom, equinní metabolický syndrom, dlouhodobé užívání kortikosteroidů), záněty a sepse, otravy (např. hobliny z ořešáku černého v podestýlce) a mechanické vlivy. Lehce stravitelné sacharidy najdeme především v jaderném krmivu, nebezpečné mohou být překvapivě i pastva (často bohatá na NSC) a náhlá změna složení krmné dávky.
Nadbytek lehce stravitelných sacharidů vede k nárazovitému přemnožení bakterií štěpících tyto cukry a narušení běžné mikroflóry, která umírá a uvolňuje endotoxin (složka bakteriální stěny). Postupně umírají i přemnožené bakterie. Endotoxin se vstřebává do krevní cirkulace a dostává do kopytních kapilár, které poškozuje. Inzulinová rezistence je stav, kdy tkáně nejsou schopny reagovat na inzulin (pankreatický hormon stimulující vstup glukózy do buněk) a přetrvávající hyperglykémie stimuluje jeho nadměrné uvolňování vedoucí k hyperinzulinémii. Vysoká hladina inzulinu je ale schopná poškozovat kopytní lamely.
Možným mechanismem je inzulinem aktivovaná sekrece růstového faktoru (IGF1), který urychluje růst lamel, jež ale nejsou dostatečně kvalitní a neplní svoji funkci. Záněty a sepse mohou být důsledkem zadržení lůžka, kolitid, těžkých pneumonií apod. Uvolněné toxiny poté narušují lamely. Mechanické vlivy zahrnují především přetěžování končetin v důsledku neschopnosti používat druhou končetinu (např. kvůli zranění), otřesy, excesivní práci na tvrdém povrchu. Nadměrné přetěžování nebo otřesy narušují cirkulaci krve v kopytu.
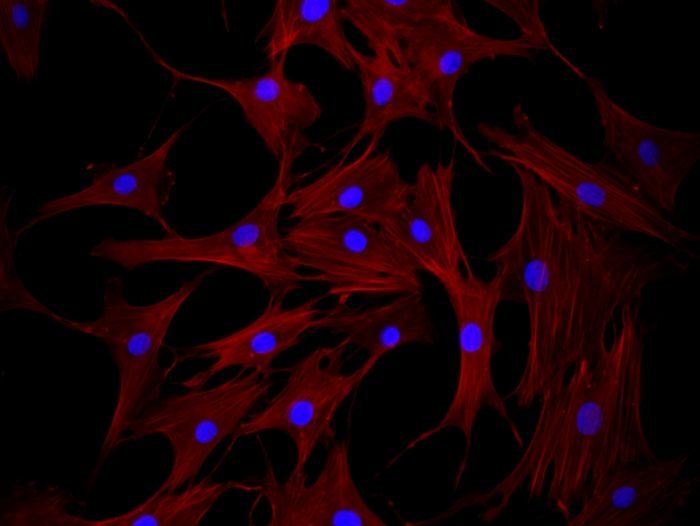
Mezenchymální kmenové buňky
Můžeme rozlišit tři stadia laminitidy.
Prodromální (preklinická) fáze probíhá od začátku působení inzultu do prvních klinických příznaků, trvá řádově v hodinách (většinou kolem 12 hodin). Dochází ke změnám na lamelách a odlučování bazální membrány. Pokud je léčba zahájena v této fázi, lze stav zvrátit. V této fázi se ještě nevyskytují symptomy a bolestivost, a tak bývá bohužel často přehlédnuta.
Akutní laminitida trvá hodiny až dny, objevují se typické projevy. Kopyto je bolestivé, temperuje, lze palpovat pulzaci cév (digitální pulzace). Dalšími příznaky jsou kulhání, neochota k pohybu, odlehčování končetiny a změny v postoji (tzv. saw horse stance). Zvíře se snaží přenést váhu na nebolestivé části kopyta, přední nohy jsou natažené dopředu (váha se tím přesune blíže zadnímu okraji kopyta) a zadní většinou též, aby pomohly podpírat předním končetinám váhu těla. V případě postižení všech končetin jsou přední více vepředu a zadní více vzadu, než je normální. Při úplné ztrátě závěsného aparátu může dojít k penetraci kopytní kosti chodidlem, až k vyzutí kopyta.
Po přechodu do chronické fáze jsou změny závěsného aparátu nevratné, dochází k prohlubování problému. Chronický stav lze jen kontrolovat a je pravděpodobné, že schvácení se bude časem opakovat.
Na laminitidu nás mohou upozornit klinické příznaky, tvar kopyta, tloušťka bílé čáry (širší, separovaná), avšak nejdůležitějším vyšetřením je rentgenologie kopyta. Na vznikající laminitidu nás mohou upozornit i příznaky související s vyvolávajícím onemocněním (horečka při zadržení lůžka, průjem při překrmení jádrem, třes, tachykardie atd.). Nápomocná je i venografie.
Při podezření na laminitidu zvířeti zajistíme klidový režim, měkkou a vysokou podestýlku (může být i písek), můžeme začít s chlazením kopyt a zvířeti nebráníme v ulehnutí. Čím dříve s léčbou začneme, tím příznivější je prognóza. Při přechodu do chronického stadia není už stav vyléčitelný. Ideální by bylo začít léčbu v prodromální bezpříznakové fázi, dokud není poškozen endotel a nevytvoří se agregáty destiček/leukocytů v cévách. Pokud existuje podezření (např. překrmení jádrem), lze nasadit heparin, endotoxinové antisérum a kryoterapii (chladit cca 48 hodin). Po nástupu akutní fáze jsou většinou předepisovány léky proti bolesti a zánětu (NSAID – fenylbutazon, flunixin), vazodilatancia (léky rozšiřující cévy), antikoagulancia, antibiotika v případě infekce. Lze podávat minerální oleje k pročištění trávicího traktu. Někdy může pomoci vypodložení kopyt měkkým materiálem (látka, vata, různé podkovářské tmely), „botičky“, zasádrování, podložky, závěsná síť aj. Velkým přínosem je chlazení kopyt na povrchovou teplotu kopyta pohybující se kolem 5–10 °C. Pokles teploty o 10 °C sníží aktivitu poškozujících enzymů o 50 %. Způsoby chlazení kopyt mohou být různé – kbelíky s vodou a ledem, speciální nádrže, stání v proudící vodě (potok, řeka) aj. Chlazení nemá význam u laminitidy z přetížení. V případě vzniku laminitidy v důsledku jiného celkového onemocnění je třeba začít řešit primární příčinu.
U chronických případů je léčba obdobná, důležité je dodržovat klidový režim a upravit stravu (dostatek vlákniny, vyhýbat se lehce stravitelným sacharidům, namáčení stravy pro odstranění karbohydrátů). Jako doplněk lze do potravy přidávat vitamíny podporující zdraví kopyta (např. biotin). Vhodné jsou i různé úpravy kopyta, jejichž cílem je odlehčit poškozené přední části a přenést váhu dozadu na střelku a udržovat nižší patky. Je možné i resekovat poškozenou dorzální stěnu nebo provést uvolňovací řezy na korunce (abnormálně rostoucí rohovina na ni tlačí). Poslední možností (protože je nevratná a nemá vědecky prokázaný význam) je přetnutí šlachy hlubokého ohybače.

Prognóza laminitidy je variabilní – může nastat uzdravení a návrat k práci, často ale v budoucnu proběhne recidiva onemocnění. Těžký průběh a vysoká bolestivost může vést až k rozhodnutí o provedení eutanazie.
Současný výzkum naznačuje, že mezenchymální kmenové buňky (MSCs), které dávají vznik více typům buněčných populací, mají velmi slibný terapeutický potenciál. MSCs vykazují určité molekulární a fyziologické vlastnosti, které umožňují využít je v klinické praxi v mnoha lékařských oborech. Lze je použít k efektivní léčbě konkrétních zdravotních postižení i u koní, a to včetně laminitidy. U koní je laminitida běžným ischemickým klinickým stavem obvykle spojeným se ztrátou p63 pozitivních epidermálních kmenových buněk. V klinických studiích se aplikace MSCs jeví jako výhodný doplněk k tradiční podpůrné léčbě, zejména před generováním hyperplastické nediferencované lamely (lamelární klín).
Účinnost léčby poraněné tkáně pomocí MSCs však může silně záviset na molekulárním fenotypu a druhu tkáně, ze které byly izolovány. Pro své imunomodulační a protizánětlivé vlastnosti jsou MSCs slibné také pro léčbu poškození souvisejících se zánětem a pro regeneraci tkání. Mají antioxidační účinky, zachovávají endoteliální integritu a podporují angiogenezi. Nedávná zjištění navíc jasně naznačují parakrinní a autokrinní aktivitu MSCs během různých regeneračních procesů. In vitro i na zvířecích modelech bylo prokázáno, že MSCs mohou produkovat a vylučovat bioaktivní molekuly, včetně antagonistů receptoru interleukinu-1 (IL1-Ra, IRAP), faktoru 1 odvozeného ze stromálních buněk (SDF-1), gen 6 indukovatelný nádorovým nekrotickým faktorem (TSG-6) a stanniocalcin-1 (STC-1), a tím se podílet na ochranných mechanismech.
V posledních letech byly popsány různé zdroje MSCs, včetně kmenových buněk odvozených z kostní dřeně, z tukové tkáně, z pupečníku a mnoha dalších. Zdá se, že různé skupiny kmenových buněk mají jedinečné vlastnosti, které by šlo potenciálně využít k léčbě konkrétní poraněné tkáně.
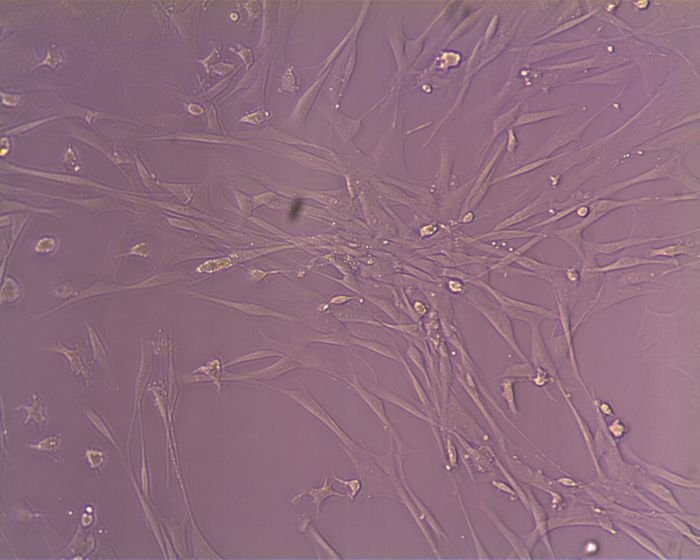
Mezenchymální kmenové buňky z kostní dřeně
V jedné studii byly MSCs izolované z tukové tkáně aplikovány celkem devíti koním ve formě suspenze v autologní plazmě obohacené o krevní destičky (PRP). Aplikace byla provedena do prstní žíly, přičemž byla opakována celkem třikrát v měsíčních odstupech. Pro první aplikaci byly vždy použity alogenní buňky, u dalších dvou autologní. Již po první aplikaci došlo u koní ke zlepšení typických příznaků, jako je zvýšený tep na digitálních arteriích, neochota k pohybu, kulhání. Po skončení terapie se tvar i pevnost kopyta postupně zregenerovaly. S ročním odstupem se recidiva laminitidy objevila pouze u dvou koní, zbylých sedm se vrátilo k plnohodnotnému aktivnímu životu.
Alogenní MSCs poskytují lepší výsledky při intravenózní aplikaci ve srovnání s epidermální aplikací. Zpočátku byly aplikovány alogenní kmenové buňky a PRP, zatímco následné aplikace zahrnovaly pouze autologní buňky. Aplikace proběhla ve třech nebo v šesti dávkách. Ve všech případech bylo u laminitického kopyta zaznamenáno zlepšení jak anatomie (kvalita a tvar), tak jeho fyziologie zvyšující pohyblivost zvířete.
U těchto případů venografie ukázala, že vaskularizace dorzálně distální části vážně poškozeného prstu byla významně zlepšena po prvních dvou ošetřeních MSCs, a po třetím ošetření bylo dosaženo téměř úplné obnovy. Většina zvířat vykazovala před terapií vážné poškození schopnosti stát v normálním postoji nebo chodit. Léčba zlepšila pohodu koní a každému zvířeti poskytla šanci na dobrou kvalitu života. Venografie demonstrovala postupné zlepšování vaskularizace nohy, což bylo zřejmě zlepšením cévní sítě, počínaje povrchovou a proximální oblastí kopyta a hlubokou a distální vrstvou konče. Stupeň vaskulárního zotavení, který byl v klinických případech různorodý, byl charakterizován průběžnou konstantní progresí.
V jiné studii byla poprvé popsána izolace MSCs ze škáry korunky koní. Tyto buňky se svými vlastnostmi shodují s MSCs z jiných tkání. Rozdíl je pouze v tom, že jsou schopné chondrogenní a osteogenní, nikoli však adipogenní diferenciace. Protože se jedná o MSCs pocházející z tkáně zajišťující výživu kopytní tkáně, usuzují autoři, že by se měly prozkoumat možnosti jejich využití v buněčné terapii laminitidy.
Zdroje:
AVECELL
 Ing. Petra Černá a MVDr. Markéta Slaná jsou členy týmu projektu Avecell. AVECELL® je veterinární projekt Medicínského centra Praha, v němž se tým odborníků zaměřuje na výzkum a využití nových metod léčby pomocí aplikace kmenových buněk ve veterinární medicíně.
Ing. Petra Černá a MVDr. Markéta Slaná jsou členy týmu projektu Avecell. AVECELL® je veterinární projekt Medicínského centra Praha, v němž se tým odborníků zaměřuje na výzkum a využití nových metod léčby pomocí aplikace kmenových buněk ve veterinární medicíně.
Medicínské centrum Praha získalo povolení pro výrobu veterinárního léčivého přípravku (autologní mezenchymální kmenové buňky) od Ústavu pro státní kontrolu veterinárních biopreparátů a léčiv (ÚSKVBL) v květnu 2015.

Když do arény vjížděl kočár fenomenálního Australana Boyda Exella, zraky všech se upíraly především na ...

Otec české hipologie František Bílek, vizionář a muž, bez něhož by svět přišel o unikátní plemeno staro...