Název onemocnění je spojen typickým cyklickým opakováním i přes medikamentózní terapii. Z toho je patrné, že pokud se objeví první zánět oka, nedá se ještě konstatovat, že jde o měsíční slepotu. Nicméně je dobré zánět nepodcenit. Každá další epizoda, za předpokladu, že šlo opravdu o ERU, oko většinou více poškodí. Ve své podstatě se jedná o zánět, vzniklý na základě poruchy autoimunitního systému oka. Primárně bývá lokalizován v přední komoře oční a může se rozšířit na celé oko. Infekčním agens jsou cca v 70 % leptospiry a na zbytku se podílejí jiné bakterie, viry a plísně.
 Přesné příčiny stále nejsou jasné, přestože vědci zjistili, že na opakujících se zánětech se podílejí i T-lymfocyty (bílé krvinky odpovědné především za buněčně zprostředkovanou imunitu) a ničí sítnici. K typickým příznakům probíhající uveitidy patří: zarudnutí, otok, bolestivost, citlivost na světlo, krev či hnis v oku, mžourání, zúžení zornice, slzení nebo kalné skvrny v oku.
Přesné příčiny stále nejsou jasné, přestože vědci zjistili, že na opakujících se zánětech se podílejí i T-lymfocyty (bílé krvinky odpovědné především za buněčně zprostředkovanou imunitu) a ničí sítnici. K typickým příznakům probíhající uveitidy patří: zarudnutí, otok, bolestivost, citlivost na světlo, krev či hnis v oku, mžourání, zúžení zornice, slzení nebo kalné skvrny v oku.
V konečném důsledku zánětu může dojít k poškození rohovky, čočky a dalších struktur oka. V akutní fázi onemocnění je klasická equinní rekurentní uveitida velmi snadno rozpoznatelná. Vyskytuje se akutní bolestivost spojená s mhouřením očí a barevnými změnami rohovky. Tyto příznaky jsou zafixovány v podvědomí naprosté většiny chovatelů koní.
Na toto onemocnění neexistuje v současné době léčba. Jeho příčina vzniku je i v současnosti ne zcela objasněna, a proto je onemocnění kauzálně obtížně ovlivnitelné a terapeutické postupy se přednostně soustředí na zvládnutí zánětlivého procesu a tlumení recidiv. V současné době probíhají klinické studie, ve kterých se k terapii equinní rekurentní uveitidy používají kmenové buňky. Mezenchymální kmenové buňky jsou účinné při snižování aktivace imunitních buněk in vitro u mnoha druhů, což z nich činí potenciální terapeutické využití pro ERU. Tato terapie se zdá být velmi účinnou a je možné, že v budoucnu bude nahrazovat chirurgickou metodu.
Kmenové buňky mají ve veterinární medicíně mimořádný význam hlavně pro své široké využití. Jednou z funkcí kmenových buněk je schopnost regenerace poškozené tkáně. V této oblasti medicíny se nejvíce využívají mezenchymální kmenové buňky. Tyto buňky se mohou diferencovat do tkání, které vznikají z mezodermu (kostí, chrupavek, vazů, svalů, tukové tkáně).
Mezenchymální kmenové buňky (MSCs) jsou multipotentní kmenové buňky, které jsou schopny sebeobnovy a nacházejí se hlavně v kostní dřeni. Dalšími zdroji jsou např. tuková tkáň nebo periferní krev. Existují studie, které dokazují, že MSCs jsou distribuovány prostřednictvím krve do jiných orgánů nebo tkání. MSCs udržují homeostázu v mikroprostředí či mobilizují chemokinové signály a tím spouštějí regenerační proces v poškozených orgánech.
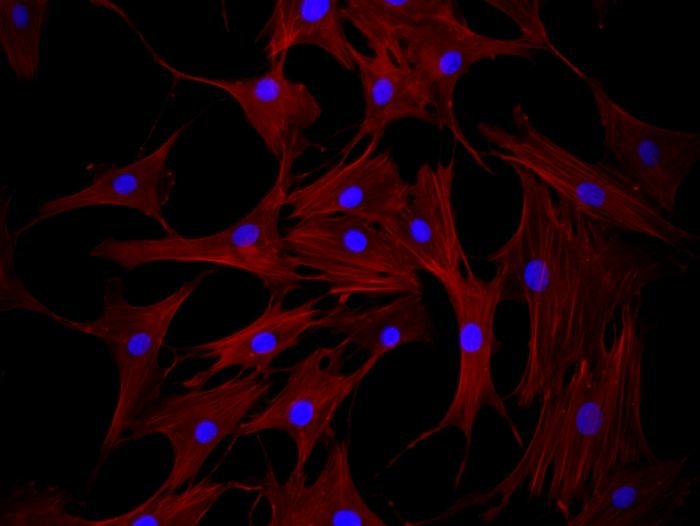
Předpokládá se, že MSCs mohou vylučovat velké množství bioaktivních molekul, které přispívají k imunomodulační funkci a restrukturalizaci na vhodné mikroprostředí pro přípravu nové regenerace tkání nebo tkáňových náhrad. Imunomodulační aktivita může chránit místo poranění od přehnané imunitní reakce tím, že koriguje aktivaci a proliferaci T-buněk. Také tlumí chronickou zánětlivou reakci organismu.
Slibné výsledky preklinických a klinických studií již byly popsány v léčbě několika onemocnění, jako je equinní rekurentní uveitida, diabetes mellitus, chronická myeloidní leukémie, cirhóza, plicní fibróza, Crohnova nemoc, srdeční selhání a poruchy nervového systému.
Jde o imunitně zprostředkované onemocnění charakterizované opakujícími se epizodami nitrookulárních zánětů. Etiologie rekurentní uveitidy je multifaktoriální a není plně objasněna. Je ale jisté, že zde imunitní systém hraje velmi důležitou roli. Po klidových fázích nastupují nové, mnohem agresivnější ataky uveálního aparátu. Plíživá forma ERU je spojená s nebolestivou, mírnou formou uveitidy, která probíhá ve zdánlivě zdravém oku a postupně vyústí v degeneraci vnitřních struktur. Tato forma je mnohem častěji popisována u plemene appaloosa a u chladnokrevníků. Klidová fáze klasické ERU nebo její plíživá forma mohou být velmi často přehlédnuty.

Vzhledem ke skutečnosti, že etiologie ERU není dosud zcela objasněna, nelze účinně působit proti příčině vzniku onemocnění, ale pouze tlumit a zpomalovat následky onemocnění. Hlavním cílem léčby je zachování zraku, snížení bolesti a omezení recidiv. Běžná terapie tohoto onemocnění se zaměřuje na redukci symptomů, proto se aplikují mydriatika (léky rozšiřující zornici), léky na potlačení zánětu a zmírnění bolesti a v posledních letech se uplatňuje aplikace cyklosporinového implantátu (tlumí reakce imunitního systému). Cyklosporinový implantát je spolehlivá chirurgická technika k řešení rekurentní uveitidy za účelem prodloužení a udržení zraku u koní. Minimální rizika spojená s implantací jsou jeho hlavní předností.
Základem úspěchu je správné posouzení a výběr kandidáta pro danou techniku. K potlačení zánětu lze použít kortikoidy lokálně nebo subkonjunktiválně (do spojivkového vaku), příp. v kombinaci s antibiotiky. Při bouřlivém průběhu se kortikoidy, nesteroidní antiflogistika i antibiotika aplikují celkově. Lokální preparáty se aplikují zpočátku každých čtyři až šest hodin.
Používaná antibiotika jsou většinou širokospektrá.
Terapii je třeba udržovat několik týdnů až měsíců a nelze ji zakončit náhle. Frekvenci aplikace léků je třeba snižovat, dokud klinické příznaky zcela neodezní, a pak ještě po dobu jednoho až dvou týdnů. S ohledem na světloplachost musí být kůň umístěn ve stáji tak, aby nebyl iritován prudkým světlem.
Díky svým imunomodulačním vlastnostem by se v terapii této choroby mohly uplatnit kmenové buňky. Skupina autorů z veterinární univerzity v Davisu (Kalifornie) vydala článek o jejich výzkumu schopnosti mezenchymálních kmenových buněk (MSC) z tukové tkáně potlačovat funkci T-lymfocytů (imunitních buněk). T-lymfocyty vylučují prozánětlivé faktory (např. interferon gama nebo interleukiny), které napadají buňky oka. V patogenezi onemocnění se nejvíce uplatňují T-lymfocyty s povrchovým znakem CD4+. Mezenchymální kmenové buňky naopak vylučují faktory s protizánětlivými účinky (např. prostaglandiny či oxid dusný) a zároveň podporují produkci T-regulačních buněk, které taktéž pomáhají bojovat proti zánětu.
Ve studii autoři izolovali mezenchymální kmenové buňky z tukové tkáně zdravých koňských dárců a dále CD4+ T-lymfocyty z krve jiných koňských dárců. Po izolaci byly oboje buňky kultivovány společně a následně byla pomocí průtokové cytometrie stanovována přítomnost znaku CD4+ (tzn. přítomnost T-lymfocytů) a přítomnost faktorů, vylučovaných těmito buňkami. Bylo zjištěno, že MSC zcela nesnižují výskyt CD4+ lymfocytů, ale významně snižují produkci prozánětlivých faktorů těmito buňkami. Autoři navíc odkazují i na svou předešlou studii, ve které prokazují bezpečnost podání MSC do periferní žíly koně.

Obecně platí, že prognóza koní postižených ERU je špatná. Záleží na mnoha faktorech, které současně ovlivňují vývoj a progresi onemocnění. Hlavním negativem je stále fakt neznalosti etiologie onemocnění. Mezi zásadní činitele ovlivňující prognózu ERU patří vnímavost pacienta na symptomatickou terapii, síla a frekvence návratů zánětlivých epizod, znalost či neznalost vyvolávajícího faktoru a imunitní stav jedince. Rovněž úroveň hygieny ustájení a ošetřovatelské péče nemalou měrou ovlivňují průběh a následky rekurentní uveitidy.
Všechny tyto informace opět potvrzují imunomodulační vlastnosti mezenchymálních kmenových buněk a slibují do budoucna možnost léčby imunitně zprostředkovaných onemocnění, jako je právě měsíční slepota.
Budou ještě nutné další rozsáhlé klinické studie, ale stále je to nadějná cesta k řešení tohoto vážného problému u koní.
Zdroje:


Ing. Petra Černá působí jako odborný asistent projektu Avecell. AVECELL® je veterinární projekt Medicínského centra Praha, v němž se tým odborníků zaměřuje na výzkum a využití nových metod léčby pomocí aplikace kmenových buněk ve veterinární medicíně.
Medicínské centrum Praha získalo povolení pro výrobu veterinárního léčivého přípravku (autologní mezenchymální kmenové buňky) od Ústavu pro státní kontrolu veterinárních biopreparátů a léčiv (ÚSKVBL) v květnu 2015.
Hříběcí – onemocnění, které se navzdory svému názvu netýká jen mladých koní – představuje v chovu z...

Slavné závodiště v Cheltenhamu, které je považováno za Mekku překážkových dostihů, hostilo o víkendu tra...